Latihan 8
1. hitung energi ikat nuklir (dalam J) dan energi ikat nuklir per nukleon
- menghitung energi ikatan inti

- menghitung perubahan massa

- hitung energi yang dilepaskan

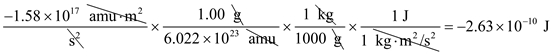
- membagi energi ikat nuklir dengan jumlah nukleon

- ubah pm ke cm dengan

- mengubah memberikan massa atom 235amu ke gram
- temukan massa jenis dengan membagi massa dengan volume

 melambangkan elektron dari orbital atom.
melambangkan elektron dari orbital atom. elektron bukan dari orbital atom
elektron bukan dari orbital atom melambangkan elektron bukan dari orbital atom.
melambangkan elektron bukan dari orbital atom. elektron dari orbital atom
elektron dari orbital atom
 melambangkan elektron dari orbital atom.
melambangkan elektron dari orbital atom.
 melambangkan elektron bukan dari orbital atom.
melambangkan elektron bukan dari orbital atom.massa atom = 232
nomor atom = 90
Massa atom tetap ada tetapi nomor atomnya berubah
78
Unsur radioaktif yang diperoleh adalah
Kuis 8
Chapter 13
1. Laju reaksi A + B → AB dapat dinyatakan sebagai …
a. penambahan konsentrasi A tiap satuan waktu
b. penambahan konsentrasi B tiap satuan waktu
c. penambahan konsentrasi AB tiap satuan waktu
d. penambahan konsentrasi A dan B tiap satuan waktu
e. penambahan konsentrasi A, B dan AB tiap satuan waktu
Pembahasan:
Karena A dan B merupakan reaktan sehingga akan mengalami pengurangan tiap satuan waktu. Sedangkan AB merupakan produk dari reaktan sehingga akan terus bertambah tiap satuan waktu.
2. Suatu katalis mempercepat reaksi dengan cara meningkatkan ….
a. jumlah tumbukan molekul
b. energi kinetik molekul
c. perubahan entalpi
d. energi aktivasi
e. jumlah molekul yang memiliki energi di atas energi aktivasi
Pembahasan:
Jumlah molekul yang memiliki energi di atas energi aktivasi dan menurunkan energi aktivasi sehingga reaksi dapat terjadi lebih cepat.
Chapter 14
1. Suatu sistem reaksi dalam keadaan setimbang bila…
a. Reaksi berlangsung dua arah pada waktu bersamaan
b. Reaksi berlangsung dalam dua arah dalam laju reaksi yang sama
c. Jumlah mol zat yang ada pada keadaan setimbang selalu sama
d. Masing-masing zat yang bereaksi sudah habis
e. Jumlah zat yang terbentuk dalam reaksi sama dengan pereaksi
Pembahasan:
Kesetimbangan dinamis yaitu proses bolak-balik dengan laju yang sama untuk kedua arah. Proses kesetimbangan dinamis ini dapat terjadi pula dalam suatu reaksi kimia.
2. Agar pada reaksi kesetimbangan:
![]()
Jumlah gas NO yang dihasilkan maksimal, maka tindakan yang diperlukan adalah…
a. Menaikan tekanan
b. Menurunkan takanan
c. Mengecilkan volum
d. Menaikan suhu
e. Memperbesar volume
Pembahasan:
Menurut Azas Le Chatelier, jika sistem dalam kesetimbangan terjadi kenaikan suhu, maka akan terjadi pergeseran kesetimbangan kearah reaksi yang menyerap kalor (Apabila koefisien sama antara produk dan reaksi maka volume dan tekanan tidak mempengaruhi reaksi.
Reaksi diatas termasuk reaksi endoterm jadi jika dinaikkan suhu maka kesetimbangan akan bergeser kearah reaksi endoterm atau bergeser kearah kanan (NO), jika reaksi bergeser kerah kanan maka nilai Kc akan semakin besar.
Chapter 15
1. Perhatikan reaksi berikut ini!
1. HF + H2O -> F- + H3O+
2. NH3+ H2O -> NH4+ + OH-
3. C6H5COOH + H2O -> C6H5COO- + H3O+
4. RNH2+ H2O -> RNH3 + OH-
Air merupakan salah satu zat yang bersifat amfoter, artinya dapat bertindak sebagai asam maupun basa. Reaksi yang menunjukkan air bertindak sebagai basa adalah ….
a. 1, 2, dan 3
b. 1 dan 3
c. 2 dan 4
d. 4 saja
e. 1, 2, 3, 4
Pembahasan:
Asam Basa Bronsetd-Lowry adalah pasangan asam basa yang hanya berbeda pada satu atom H saja. Asam memiliki atom H lebih banyak dibandingkan basa.
Pada reaksi (1) HF + H2O -> F- + H3O+
H2O berpasangan dengan H3O+, H2O memiliki atom H 1 lebih sedikit dibandingkan H3O+ sehingga H2O pada reaksi ini bertindak sebagai basa.
Pada reaksi (3) C6H5COOH + H2O -> C6H5COO- + H3O+
H2O berpasangan dengan H3O+, H2O memiliki atom H 1 lebih sedikit dibandingkan H3O+ sehingga H2O pada reaksi ini bertindak sebagai basa.
2. Larutan asam lemah NH4OH 0,1 M dan Kb = 10-5 , nilai pH larutan tersebut adalah… . .
a. 11
b. 3
c. 9
d. 14
e. 6
Pembahasan:
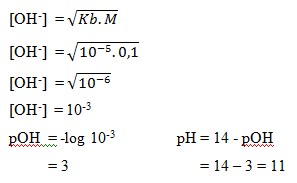
Chapter 16
1. Asam sulfat sebanyak 20 ml dititrasi dengan larutan NaOH 0,1 M. Jika ternyata diperlukan 30 ml NaOH, kemolaran larutan asam sulfat tersebut adalah…..
a. 0,075 M
b. 0,10 M
c. 0,15 M
d. 0,20 M
e. 0,30 M
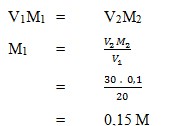
2. Larutan CH3COOH 0,1 M terionisasi dengan derajat ionisasi α= 0,01 mempunyai pH sebesar…..
a. 1
b. 2
c. 3
d. 4
e. 5
Jawab: C
Pembahasan:
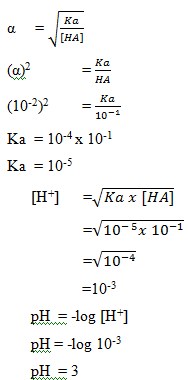
Chapter 17
1. 1,5 m3 gas helium yang bersuhu 27°C dipanaskan secara isobarik sampai 87°C. Jika tekanan gas helium 2 x 105 N/m2, gas helium melakukan usaha luar sebesar…
A. 60 kJ
B. 120 kJ
C. 280 kJ
D. 480 kJ
E. 660 kJ
Jawab: A
Pembahasan:
V1 = 1,5 m3
T1 = 27°C = 300 K
T2 = 87°C = 360 K
P = 2 x 105 N/m2
W = PΔV
Mencari V2 :
V2/T2 = V1/T1
V2 = ( V1/T1 ) x T2 = ( 1,5/300 ) x 360 = 1,8 m3
W = PΔV = 2 x 105 (1,8 − 1,5) = 0,6 x 105 = 60 x 103 = 60 kJ.
2. Mesin Carnot bekerja pada suhu tinggi 600 K, untuk menghasilkan kerja mekanik. Jika mesin menyerap kalor 600 J dengan suhu rendah 400 K, maka usaha yang dihasilkan adalah…
A. 120 J
B. 124 J
C. 135 J
D. 148 J
E. 200 J
Jawab: E
Pembahasan:
η = ( 1 − Tr / Tt ) x 100 %
Hilangkan saja 100% untuk memudahkan perhitungan :
η = ( 1 − 400/600) = 1/3
η = ( W / Q1 )
1/3 = W/600
W = 200 J.
Chapter 18
1. Logam yang tidak diperoleh dengan proses elektrolisis adalah …
a. Natrium
b. Aluminium
c. Magnesium
d. Kalsium
e. Merkuri
Jawab: E
Pembahasan:
Logam-logam Natrium, Aluminium, Magnesium, dan Kalsium diperoleh dengan proses elektrolisis, sebab logam-logam ini tergolong reduktor kuat. Logam Merkuri (Raksa) adalah logam yang berwujud cair pada suhu kamar, tidak diendapkan di Katode.
Logam ini diperoleh dengan Pemanggangan HgS atau pemanasan HgO.
Reaksinya :
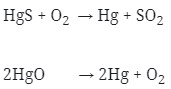
2. Bila diketahui potensial elektrode standar dari :
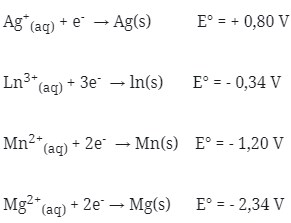
Pasangan sel volta yang akan menghasilkan potensial sel sebesar 0,86 V adalah …
a. ln|ln3+||3Ag+|3Ag
b. Mg|Mg2+||Mn2+|Mn
c. Mn|Mn2+||2Ag+|Ag
d. 2ln|2ln3+||3Mn2+|3Mn
e. 3Mn|3Mn2+||2ln3+|2ln
Jawab: E
Pembahasan:
Dicari satu persatu potensial sel dari pilihan jawaban
(a) E°sel = E°katode – E°anode
= +0,80 – (- 0,34 ) = 1,14 V
(b) E°sel = E°katode – E°anode
= -1,20 – (-2,34) = 1,14 V
(c) E°sel = E°katode – E°anode
= + 0,80 – (-1,20) = 2 V
(d) E°sel = E°katode – E°anode
= – 1,20 – (- 0,34) = – 0,86 V
(e) E°sel = E°katode – E°anode
= – 0,34 – (- 1,20) = 0,86 V








